Parâmetros de Solubilidade Hansen (HSP)
Os Parâmetros de Solubilidade de Hansen (HSP) foram inicialmente desenvolvidos por Charles M. Hansen, em 1967, como uma ferramenta para prever se um material se dissolverá em outro e formará uma solução. Hoje, eles não se limitam apenas a prever a solubilidade de componentes químicos, mas também são usados para otimizar a estabilidade de suspensões de partículas ou a adesão de polímeros em superfícies. Portanto, os HSP foram considerados como um meio útil para acelerar o desenvolvimento de formulações de tintas, tintas, adesivos, cosméticos ou farmacêuticos.
Os HSP baseiam-se na ideia de que ‘semelhante dissolve semelhante’ ou, no caso de superfícies sólidas, ‘semelhante procura semelhante’.
Porém, cada componente, molécula ou superfície sólida possui três parâmetros HSP (δ), que normalmente são medidos em MPa1/2.
Os três parâmetros δ também recebem o nome de parâmetros de energia de coesão:
- δD – A energia das forças de dispersão entre as moléculas
- δP – A energia das forças intermoleculares dipolares entre as moléculas
- δH – A energia das ligações de hidrogênio entre as moléculas.
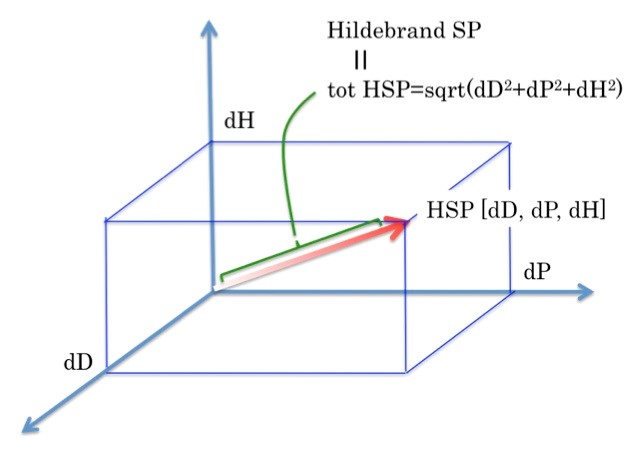
O espaço de Hansen, também conhecido como um ponto em três dimensões, trata-se de coordenadas para os três parâmetros. Dessa forma, quanto mais próximas duas moléculas estiverem neste espaço tridimensional, maior a probabilidade de elas se dissolverem uma na outra.
Embor para determinar se os parâmetros de duas moléculas [geralmente um solvente (2) e um polímero (1)] estão dentro do intervalo, um valor chamado raio de interação (R0) é dado à substância que está sendo dissolvida. Pois este valor determina o raio da esfera no espaço de Hansen e seu centro são os três parâmetros de Hansen.A fórmula utilizada para calcular a distância (R) entre os parâmetros de Hansen no espaço de Hansen é: R2a=4(δd2−δd1)2+(δp2−δp1)2+(δh2−δh1)2.
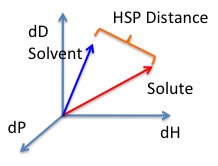
RED = Ra/Ro
- · RED < 1 as moléculas são iguais e se dissolverão
- · RED = 1 o Sistema se dissolverá parcialmente
- · RED > 1 o Sistema não se dissolverá
Ampliando o uso dos parâmetros de solubilidade de Hansen: aplicações em diversas áreas industriais e científicas
Historicamente, os parâmetros de solubilidade de Hansen (HSP) têm sido usados em indústrias como tintas e revestimentos, sendo assim, onde a compreensão e o controle das interações solvente-polímero eram vitais. Sendo assim, ao longo dos anos, seu uso foi amplamente estendido para aplicações como:
- Craqueamento por estresse ambiental de polímeros;
- Dispersão controlada de pigmentos, como negro de fumo;
- Compreensão das propriedades de solubilidade/dispersão de nanotubos de carbono, buckyballs e pontos quânticos;
- Adesão a polímeros;
- Permeação de solventes e produtos químicos através de plásticos para entender questões como segurança de luvas, propriedades de barreira de embalagens de alimentos e permeação na pele;
- Difusão de solventes em polímeros através da compreensão da concentração de superfície com base no número RED;
- Citotoxicidade via interação com DNA;
- Narizes artificiais (onde a resposta depende da solubilidade do polímero do odor de teste);
- Misturas de solventes mais seguras, baratas e rápidas onde um solvente indesejável pode ser substituído racionalmente por uma mistura de solventes mais desejáveis cujo HSP combinado é igual ao HSP do solvente origina;
- Parâmetros de solubilidade de Hansen e IGC.
Fontes de pesquisa:
- https://en.wikipedia.org/wiki/Hansen_solubility_parameter
- https://pirika.com/NewHP/PirikaE2/GSDesigner.html
- https://www.hansen-solubility.com
Por Pedro Alexandre Sertek
