Ligação UV-Vis
Teoria de Ligação para Espectroscopia UV-Visível
- Orbitais Ligantes e Antiligantes
ligação UV-Vis, quando uma ligação covalente simples é formada entre dois átomos, orbitais atômicos semipreenchidos em cada átomo se sobrepõem para formar um novo orbital molecular que contém ambos os elétrons.
Há uma forte atração entre os dois núcleos e os elétrons e é isso que mantém a molécula unida. Este é o tipo mais simples de ligação e é conhecido como ligação sigma (σ). A teoria do orbital molecular, no entanto, afirma que, se você começar com dois orbitais atômicos, deverá produzir dois orbitais moleculares. No entanto, é formado um segundo orbital molecular que na maioria dos casos não contém elétrons. Este tipo de orbital é conhecido como orbital anti-ligante e é indicado com uma estrela (*) após o símbolo. Os orbitais antiligantes têm uma forma diferente e energia mais alta do que os orbitais ligantes. Isso ocorre porque há um aumento na densidade eletrônica entre os núcleos nos orbitais ligantes e uma diminuição na densidade eletrônica nos orbitais antiligantes
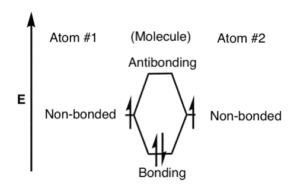
Os orbitais ligantes tem baixa energia do que os orbitais antiligantes. A energia é liberada quando os orbitais de ligação são formados tornando, mais estável do que os átomos separados. Por outro lado, os orbitais antiligantes são mais energéticos do que os orbitais atômicos originais e são menos estáveis. A estabilidade em um orbital ligante é atribuível à atração entre os núcleos e os elétrons. No entanto, em um orbital antiligante não há tal atração – as forças repulsivas entre os núcleos predominam.
- Orbitais anti-ligantes em ligações duplas
Em compostos como alcenos, há uma ligação dupla entre os átomos de carbono. No caso do eteno, dois dos orbitais hibridizados sp2 (em cada um dos átomos de carbono individuais) são usados para formar ligações σ com os orbitais 1s do hidrogênio. Os orbitais sp2 restantes em cada um dos átomos de carbono se sobrepõem para formar uma ligação σ C-C. Os dois orbitais p restantes contêm um único elétron; a sobreposição desses orbitais forma uma ligação π, criando uma ligação dupla entre os dois átomos de carbono. A ligação π é um orbital ligante. Como mencionado anteriormente, a combinação de dois orbitais atômicos deve produzir dois orbitais moleculares, portanto, um orbital anti-ligante π* também é formado. Como o orbital antiligante σ*, os orbitais antiligantes π* são mais energéticos do que o orbital ligante. Ambos os elétrons serão encontrados no orbital de ligação π.
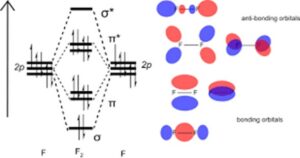
- Energias relativas dos orbitais
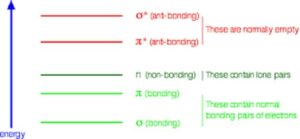
Cada tipo de orbital terá uma energia diferente. Os orbitais não ligantes (n) contêm pares isolados de elétrons, por exemplo, em átomos de oxigênio, nitrogênio ou halogênio, que não contribuem para a formação de ligações σ ou π.
Quando a radiação eletromagnética é absorvida pela molécula, um elétron pode ser promovido de um orbital ligante ou não ligante para um orbital antiligante. A diferença de energia (ΔE) entre os orbitais determina a frequência (ou comprimento de onda) da luz que é absorvida.

Diferentes tipos de compostos diferem em seus níveis de energia orbital, dando origem a espectros UV-visíveis específicos. A energia necessária para a transição depende principalmente da extensão da conjugação (ou seja, o número de ligações pi consecutivas, grosso modo). Um alceno com pouca ou nenhuma conjugação (por exemplo, eteno, CH2=CH2) possui uma grande lacuna de energia (ΔE) entre os orbitais ligantes e antiligantes, o que requer fótons mais energéticos (comprimento de onda mais curto) para excitação.
Para o eteno, a absorbância máxima ocorre em cerca de 170 nm, na região do UV. À medida que a conjugação aumenta, o intervalo de energia ΔE diminui, empurrando o comprimento de onda de absorção máxima (λmax) em direção ao visível (fótons menos energéticos, comprimento de onda mais longo). Por exemplo, β-caroteno (o pigmento laranja em cenouras) com 11 ligações pi conjugadas, absorve no visível (λmax = 470 nm).
Conheça nosso curso livre a distância sobre o assunto:
https://www.amoreiraconsultoria.com/cursos/cld-espectroscopia-uvvis/
Por Pedro Alexandre
